Produktbeschreibung
- Bezeichnung des Tierarzneimittels
Felpreva Lösung zum Auftropfen für kleine Katzen (1 - 2,5 kg)
Felpreva Lösung zum Auftropfen für mittelgroße Katzen (> 2,5 - 5 kg)
Felpreva Lösung zum Auftropfen für große Katzen (> 5 - 8 kg)- Zusammensetzung
Jeder Tropfapplikator enthält:
Felpreva
Lösung zum AuftropfenVolumen der Einzeldosis (ml) Tigolaner
(mg)Emodepside
(mg)Praziquantel
(mg)Für kleine Katzen
(1,0 – 2,5kg)0,37 36,22 7,53 30,12 Für mittelgroße Katzen
(>2,5 – 5,0kg)0,74 75,45 15,06 60,24 Für große Katzen
(>5,0 – 8,0 kg)1,18 115,52 24,01 96,05 Sonstige Bestandteile:
Butylhydroxyanisol (E320) 2,63 mg/ml
Butylhydroxytoluol (E321) 1,10 mg/mlKlare, gelbe bis rote Lösung. Während der Lagerung kann eine Veränderung der Farbe auftreten. Diese Erscheinung hat keinen Einfluss auf die Produktqualität
- Zieltierart(en)
Katze
- Anwendungsgebiet(e)
Für Katzen mit bestehenden parasitären Mischinfestationen /-infektionen oder bei Vorliegen eines entsprechenden Gefährdungspotentials. Das Tierarzneimittel ist ausschließlich für eine gleichzeitig auf Ektoparasiten, Cestoden und Nematoden gerichtete Therapie indiziert.
Ektoparasiten
- Zur Behandlung eines Floh- (Ctenocephalides felis) und Zeckenbefalls (Ixodes ricinus, Ixodes holocyclus) bei Katzen mit sofortiger und anhaltender abtötender Wirkung über 13 Wochen.
- Das Tierarzneimittel kann als Teil der Behandlungsstrategie zur Kontrolle der allergischen Flohdermatitis (FAD) eingesetzt werden.
- Zur Behandlung von leichten bis mittelschweren Fällen von Notoedres-Kopfräude (verursacht durch Notoedres cati).
- Zur Behandlung eines Ohrmilbenbefalls (Otodectes cynotis)
Gastrointestinale Rundwürmer (Nematoden)
Zur Behandlung von Infektionen mit:
- Toxocara cati (reife adulte, unreife adulte Stadien, L4 und L3)
- Toxascaris leonina (reife adulte, unreife adulte Stadien und L4)
- Ancylostoma tubaeforme (reife adulte, unreife adulte Stadien und L4)
Lungenwürmer (Nematoden)
Zur Behandlung von Infektionen mit:
- Aelurostrongylus abstrusus (adult)
- Troglostrongylus brevior (adult)
Bandwürmer (Cestoden)
Zur Behandlung von Bandwurminfektionen:
- Dipylidium caninum (reife adulte und unreife adulte Stadien)
- Taenia taeniaeformis (adult)
- Gegenanzeigen
Nicht anwenden bei Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile.
- Besondere Warnhinweise
Besondere Warnhinweise:
Ektoparasiten müssen mit der Nahrungsaufnahme auf dem Wirt beginnen, um mit Tigolaner in Kontakt zu kommen. Deshalb kann ein Risiko der Übertragung von vektorübertragenen Krankheiten nicht ausgeschlossen werden.
Die häufige, wiederholte Anwendung von Antiparasitika einer bestimmten Substanzklasse in dieser fixen Kombination kann unter bestimmten Umständen zur Resistenz von Parasiten gegenüber Antiparasitika dieser Substanzklassen führen. Um die Möglichkeit einer künftigen Resistenzselektion zu begrenzen, sollte sich die Anwendung dieses Tierarzneimittels daher auf die Beurteilung eines jeden Einzelfalls und auf lokale epidemiologische Erhebungen zur gegenwärtigen Empfindlichkeit der Zielorganismen stützen.
Schamponieren oder Eintauchen des Tieres in Wasser unmittelbar nach der Behandlung kann die Wirksamkeit des Tierarzneimittels senken. Behandelte Tiere sollten deshalb nicht gebadet werden, bevor die Lösung getrocknet ist.Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Da entsprechende Daten nicht vorliegen, wird die Behandlung von jungen Katzen unter 10 Wochen oder mit weniger als 1 kg Körpergewicht nicht empfohlen.
Dieses Tierarzneimittel ist zum Auftropfen auf die Haut bestimmt und sollte nicht auf eine andere Weise, z. B. oral, verabreicht werden.Nur auf intakte Haut auftragen. Anwenden wie unter „Hinweise für die richtige Anwendung” beschrieben, um ein Belecken durch das Tier und die Aufnahme des Tierarzneimittels zu verhindern. Vermeiden Sie ein Belecken der Applikationsstelle durch die behandelte Katze oder durch andere im Haushalt lebende Katzen, während sie noch feucht ist. Anzeichen, die nach oraler Aufnahme (z. B. durch Belecken) beobachtet werden, entnehmen Sie bitte dem Abschnitt „Nebenwirkungen“.
Das Tierarzneimittel kann Augenreizung verursachen. Bei versehentlichem Kontakt mit den Augen diese sofort mit reichlich Wasser spülen. Wenn Augenreizung auftritt, tierärztlichen Rat einholen.Es gibt keine Erfahrungen bezüglich der Anwendung des Tierarzneimittels bei kranken und geschwächten Tieren. Daher sollte das Tierarzneimittel bei solchen Tieren nur basierend auf einer Nutzen-Risiko-Bewertung angewendet werden.
Akute Anzeichen einer Pneumonie können nach der Behandlung als Ergebnis der entzündlichen Wirtsimmunantwort gegenüber dem Absterben von T. brevior Lungenwürmern auftreten, insbesondere bei jungen Katzen.Das Tierarzneimittel sollte nicht in kürzeren Intervallen als 8 Wochen angewendet werden. Aufgrund der für einen Zeitraum von 3 Monaten anhaltenden Aktivität des Tierarzneimittels gegen Flöhe und Zecken ist die Anwendung des Tierarzneimittels aus klinischer Sicht in Intervallen von weniger als drei Monaten nicht angezeigt.
Es sind keine Daten zur Zieltierverträglichkeit verfügbar, die über vier aufeinanderfolgende Behandlungen hinausgehen. Eine Akkumulation von Tigolaner ist wahrscheinlich. Weitere Behandlungen sollten gemäß einer Nutzen-Risiko-Bewertung durch den zuständigen Tierarzt auf Einzelfälle beschränkt werden. Siehe Abschnitt „Überdosierung“.Besondere Vorsichtsmaßnahmen für den Anwender:
Das Tierarzneimittel kann neurologische Symptome hervorrufen und den Blutzuckerspiegel vorübergehend erhöhen.
Während der Anwendung nicht rauchen, essen oder trinken. Hände nach Gebrauch waschen.
Gebrauchte Applikatoren sollten sofort entsorgt werden und nicht in Sicht- oder Reichweite von Kindern gelangen.
Bei versehentlichem Kontakt des Applikatorinhalts mit der Haut sofort mit Wasser und Seife waschen. Das Tierarzneimittel kann Augenreizung verursachen. Wenn das Tierarzneimittel versehentlich in die Augen gelangt, sollten diese gründlich mit reichlich Wasser gespült werden.
Bei anhaltender Haut- oder Augenreizung oder bei versehentlicher Aufnahme, besonders von Kindern, ist unverzüglich ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.Da bei Labortieren nach Gabe von Tigolaner und Emodepsid fötotoxische Wirkungen beobachtet wurden, sollten schwangere Frauen und Frauen mit Kinderwunsch Handschuhe tragen, um den direkten Kontakt mit dem Tierarzneimittel zu vermeiden
Schwangere Frauen sollten während der ersten 24 Stunden nach Anwendung des Tierarzneimittels und so lange, bis die behandelte Stelle nicht mehr erkennbar ist, Kontakt mit der Applikationsstelle vermeiden. Kinder während der ersten 24 Stunden nach Anwendung des Tierarzneimittels von behandelten Tieren fernhalten. Es sollte darauf geachtet werden, dass Kinder keinen längeren, intensiven Kontakt mit behandelten Katzen haben, bis die behandelte Stelle nicht mehr erkennbar ist. Es wird empfohlen, Tiere am Abend zu behandeln. Am Tag der Behandlung sollten behandelte Tiere nicht im selben Bett wie ihre Besitzer schlafen. Das gilt insbesondere für Kinder und schwangere Frauen.Sonstige Vorsichtsmaßnahmen:
Das Tierarzneimittel kann bei bestimmten Materialien, einschließlich Leder, Stoff, Kunststoffen und bearbeiteten Oberflächen, Flecken oder Schäden verursachen. Die Applikationsstelle vor einem Kontakt mit solchen Materialien trocknen lassen.
Trächtigkeit und Laktation:
Nach Exposition gegenüber Tigolaner und Emodepsid wurden bei Labortieren fötotoxische Effekte beobachtet. Die Unbedenklichkeit des Tierarzneimittels bei trächtigen und laktierenden Katzen wurde nicht untersucht, weshalb die Anwendung bei solchen Tieren nicht empfohlen wird.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
Emodepsid ist ein Substrat für P-Glykoprotein. Eine gleichzeitige Behandlung mit anderen Substanzen, die P-Glycoprotein-Substrate oder -Inhibitoren sind (zum Beispiel Ivermectin und andere antiparasitär wirksame makrozyklische Laktone, Erythromycin, Prednisolon und Cyclosporin) könnte pharmakokinetische Wechselwirkungen hervorrufen.
Überdosierung:
Nach vier aufeinanderfolgenden Behandlungen von Katzen ab einem Alter von 10 Wochen bzw. erwachsenen Katzen wurde bei einigen männlichen Tieren eine Abnahme des Schilddrüsengewichts beobachtet. Die Katzen hatten bis zum Fünffachen der maximal empfohlenen Dosis erhalten. Bei erwachsenen Katzen wurde eine vorübergehende Erhöhung der Leberenzyme (AST, ALT), begleitet von multifokaler Stauungsleber bei einem Tier, in der Gruppe mit hoher Dosierung (5x) und ein Anstieg des Cholesterins in allen Überdosierungsgruppen (3x, 5x) beobachtet. Klinisch wurden keine systemischen Auffälligkeiten beobachtet.
In der Gruppe mit hoher Dosis (5x) traten an der Applikationsstelle Fälle von lokalen Reaktionen auf (Alopezie, Erythem, Hyperplasie der Epidermis und/oder entzündliche Infiltrate).
Es ist kein Antidot bekannt.
- Nebenwirkungen
Katze:
Häufig
(1 bis 10 Tiere / 100 behandelte Tiere):Veränderung des Haarkleids (z.B. Verkleben)1 Sehr selten
(< 1 Tier/10 000 behandelte Tiere, einschließlich Einzelfallberichte):Reaktion an der Applikationsstelle (z.B. Kratzen, Erythem, Ausdünnen der Haare, Entzündung)2
Störung des Verdauungstrakts (z.B. Hypersalivation, Erbrechen)2,3
Neurologische Störung (z.B. Ataxie, Tremor)
Erregung, Lautäußerung4
Inappetenz41 kosmetischer Effekt, vorübergehend, an der Applikationsstelle,
2 leicht und vorübergehend
3 durch Ablecken der Applikationsstelle unmittelbar nach der Behandlung
4 nach dem Ablecken, in EinzelfällenDie Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Die Meldungen sind vorzugsweise durch einen Tierarzt über das nationale Meldesystem an das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) oder an den Zulassungsinhaber oder seinen örtlichen Vertreter zu senden. Die Kontaktdaten sind im Abschnitt „Kontaktangaben“ der Packungsbeilage angegeben. Meldebögen und Kontaktdaten des BVL sind auf der Internetseite https://www.vet-uaw.de/ zu finden oder können per E-Mail (uaw@bvl.bund.de) angefordert werden. Für Tierärzte besteht die Möglichkeit der elektronischen Meldung auf der oben genannten Internetseite.
- Dosierung für jede Tierart, Art und Dauer der Anwendung
Zum Auftropfen. Nur zur äußerlichen Anwendung.
Dosierung
Die empfohlene Mindestdosis beträgt 14,4 mg Tigolaner/kg Körpergewicht, 3 mg Emodepsid/kg Körpergewicht, 12 mg Praziquantel/kg Körpergewicht entsprechend 0,148 ml Tierarzneimittel/kg Körpergewicht.
Körpergewicht der Katze (kg) Zu verwendene Applikatorgröße: Felpreva Lösung zum Auftropfen Volumen der Einzeldosis (ml) Tigolaner (mg/kg Körpergewicht) Emodepsid (mg/kg Körpergewicht Praziquantel (mg/kg Körpergewicht) 1,0 – 2,5 Für kleine Katzen 0,37 14,5 – 36,2 3,0 – 7,5 12,0 – 30,1 2,6 – 5,0 Für mittelgroße Katzen 0,74 14,5 – 27,9 3,0 – 5,8 12,0 – 23,2 5,1 – 8,0 Für große Katzen 1,18 14,4 – 22,7 3,0 – 4,7 12,0 – 18,8 > 8,0 Verwenden Sie eine entsprechende Kombination von Applikatoren Behandlungsschema
Die Behandlung ist nur für eine gleichzeitig gegen Ektoparasiten, Cestoden und Nematoden gerichtete Therapie angezeigt. In Abwesenheit von Mischinfektionen oder einem Risiko für Mischinfektionen sollten geeignete antiparasitäre Tierarzneimittel mit engem Wirkspektrum angewendet werden.
Flöhe und Zecken
Das Tierarzneimittel bleibt über einen Zeitraum von 13 Wochen gegen Flöhe und Zecken wirksam. Falls innerhalb von 13 Wochen nach Verabreichung eine erneute Behandlung erforderlich wird, sollte ein geeignetes Tierarzneimittel mit engem Wirkspektrum angewendet werden.
Milben
Zur Behandlung von Ohrmilbenbefall (Otodectes cynotis) und Notoedres-Kopfräude (Notoedres cati) sollte eine Einzeldosis des Tierarzneimittels verabreicht werden.
Der Behandlungserfolg und die Notwendigkeit für eine Nachbehandlung mit einem geeigneten antiparasitären Tierarzneimittel mit engem Wirkspektrum sollte nach 4 Wochen durch den behandelnden Tierarzt bestimmt werden.
Aufgrund individueller Fälle von einzelnen überlebenden Ohrmilben und dem Risiko eines neuen Otocariosis-Zyklus sollte der Behandlungserfolg 1 Monat nach der Behandlung durch den Tierarzt bestätigt werden.Gastrointestinale Nematoden und Bandwürmer
Zur Behandlung von Rund- und Bandwürmern sollte eine Einzeldosis des Tierarzneimittels verabreicht werden. Die Notwendigkeit und Häufigkeit einer erneuten Behandlung sollte in Übereinstimmung mit der Empfehlung des verordnenden Tierarztes erfolgen und die lokale epidemiologische Situation sowie die Lebensweise der Katze berücksichtigen.
Falls innerhalb von 3 Monaten nach Verabreichung eine erneute Behandlung erforderlich ist, sollte ein geeignetes Tierarzneimittel mit engem Wirkspektrum verwendet werden.Lungenwürmer
Zur Behandlung gegen den Lungenwurm Aelurostrongylus abstrusus und Troglostrongylus brevior wird eine Behandlung mit dem Tierarzneimittel, gefolgt von einer zweiten Behandlung im Abstand von zwei Wochen mit einer Lösung zum Auftropfen für Katzen mit 21,4 mg/ml Emodepsid
und 85,8 mg/ml Praziquantel empfohlen, da kein Tierarzneimittel, welches nur Emodepsid als Wirkstoff enthält, verfügbar ist.- Hinweise für die richtige Anwendung
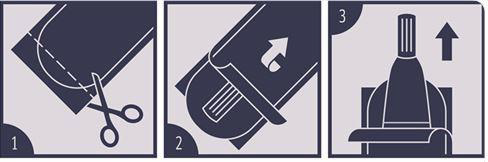
Verwenden Sie eine Schere (1), um die kindersichere Blisterpackung zu öffnen. Die Folien auseinanderziehen (2) und den Tropfapplikator aus der Packung nehmen (3).
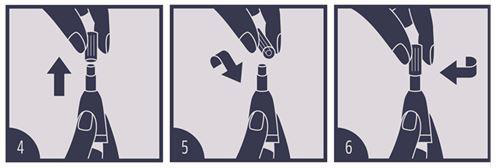
Den Applikator in aufrechter Position halten (4), die Kappe drehen und abziehen (5) und das entgegengesetzte Ende der Kappe zum Aufbrechen des Siegels verwenden (6).
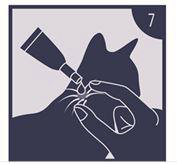
Das Nackenfell der Katze an der Schädelbasis scheiteln, bis die Haut sichtbar wird (7). Die Spitze des Applikators auf die Haut setzen und den Applikator mehrere Male fest drücken, um den Inhalt direkt auf die Haut zu leeren (7). Ein Auftropfen an der Schädelbasis verringert die Möglichkeit, dass die Katze die aufgebrachte Lösung ableckt.
- Wartezeiten
Nicht zutreffend.
- Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Für dieses Tierarzneimittel sind bezüglich der Temperatur keine besonderen Lagerungsbedingungen erforderlich.
Den Applikator in der Aluminium-Blisterpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.Sie dürfen dieses Tierarzneimittel nach dem auf dem Etikett und dem Karton angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
- Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Das Tierarzneimittel darf nicht in Gewässer gelangen, da Tigolaner, Emodepside und Praziquantel eine Gefahr für Fische und andere Wasserorganismen darstellen kann.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme. Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
- Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
- Zulassungsnummern und Packungsgrößen
EU/2/21/277/001-012
Weißer Propylenapplikator mit Propylenkappe im Aluminiumblister.
Blisterpackung in einer Faltschachtel mit 1, 2, 10 oder 20 Tropfapplikatoren (jeweils 0,37 ml).
Blisterpackung in einer Faltschachtel mit 1, 2, 10 oder 20 Tropfapplikatoren (jeweils 0,74 ml):
Blisterpackung in einer Faltschachtel mit 1, 2, 10 oder 20 Tropfapplikatoren (jeweils 1,18 ml).Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
- Datum der letzten Überarbeitung der Packungsbeilage
28.10.2024
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
- Kontaktangaben
Zulassungsinhaber und für die Chargenfreigabe verantwortlicher Hersteller:
Vetoquinol S.A.
Magny-Vernois
70200 Lure
FrankreichFür die Chargenfreigabe verantwortlicher Hersteller:
VETOQUINOL BIOWET Sp. z o.o.
Żwirowa 140
66-400 Gorzów Wlkp.
PolenÖrtlicher Vertreter und Kontaktdaten zur Meldung vermuteter Nebenwirkungen
Österreich
Vetoquinol Österreich GmbH
Gußhausstraße 14/5
1040 Wien
Austria
Tel: +43 1 416 39 10

